ライソゾーム病の原因と治療戦略
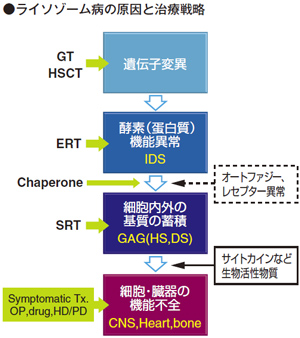 ファブリー病を含むライソゾーム病の最新治療、ライソゾーム病の原因と治療戦略についてご説明します。ライソゾーム病は遺伝子変異から酵素(蛋白質)の機能異常が起きて、細胞内外の基質の蓄積、最後は細胞・臓器の機能不全が起こる疾患群で、それぞれ病態の段階に対応して治療戦略が考えられています。
ファブリー病を含むライソゾーム病の最新治療、ライソゾーム病の原因と治療戦略についてご説明します。ライソゾーム病は遺伝子変異から酵素(蛋白質)の機能異常が起きて、細胞内外の基質の蓄積、最後は細胞・臓器の機能不全が起こる疾患群で、それぞれ病態の段階に対応して治療戦略が考えられています。
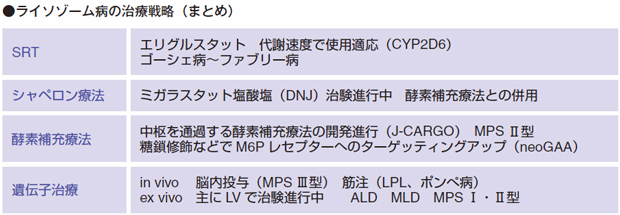
● 一番下のカラムの細胞・臓器の機能不全に対しては対症療法、手術、薬物療法、透析などが行われています。
● 細胞内外の基質の蓄積に対しては、基質合成抑制療法(SRT)が開発されています。
● 酵素(蛋白質)の形状の改善に関しては、シャペロン療法があります。
● 酵素(蛋白質)の欠乏に対しては、酵素補充療法(ERT)があります。
● 一番上の段階の遺伝子変異に対しては、遺伝子治療、骨髄移植、造血幹細胞移植が考えられます。
ライソゾーム病に対する基質合成阻害剤
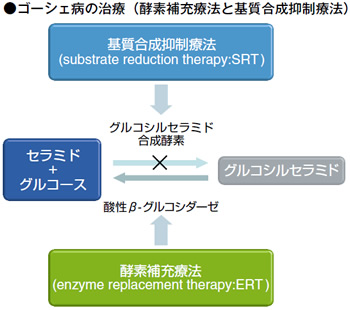
ライソゾーム病では原因酵素がないために基質が分解できず細胞・組織に蓄積します。そこで、外部から酵素を補充することによってその基質を分解しようという治療が酵素補充療法です。一方、基質合成抑制療法では、基質合成阻害剤によって基質の合成を抑えて低下しようという治療です。
基質合成阻害剤としては、ニーマン・ピック病C 型の治療薬としてミグルスタットが、本邦では2012 年に承認されています。その後、ゴーシェ病の治療薬として、エリグルスタットが本邦では2015 年に承認されています。
基質合成阻害剤としては、ニーマン・ピック病C 型の治療薬としてミグルスタットが、本邦では2012 年に承認されています。その後、ゴーシェ病の治療薬として、エリグルスタットが本邦では2015 年に承認されています。
ゴーシェ病の概要
ゴーシェ病はライソゾーム酵素であるグルコセレブロシダーゼが遺伝的に低下・欠損することにより、基質グルコシルセラミドが細胞内ライソゾームに蓄積することで発症します。Ⅰ、Ⅱ、Ⅲ型があり、Ⅰ型は神経症状のないタイプで小児期に発症し、肝脾腫、骨関節痛などが見られます。Ⅱ型は神経症状を伴う劇症型で、6 ヵ月以内の乳児に発症し、脾腫が先行し、肝腫、肺浸潤の呼吸障害で、2 歳までに亡くなってしまう急性進行の神経型です。Ⅲ型は中間型です。日本人はⅡ型の神経型が多く、ユダヤ人は軽症のⅠ型が多いといわれています。
ゴーシェ病に対する基質合成阻害剤
酵素(蛋白質)の形状の改善に関与するシャペロン療法
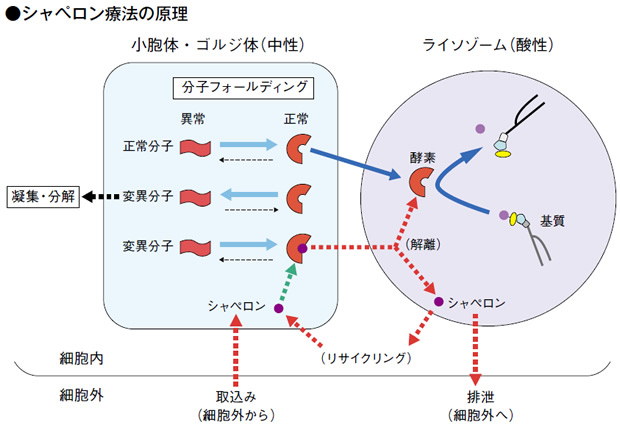
シャペロン療法は、基質分解酵素の形状が不安定なために酵素活性を示さない場合に、その酵素活性をシャペロンによって正常に機能させようという考え方の治療法です。
ライソゾーム病の場合、酵素欠損の分子状態が一様でないことがわかっています。通常、変異分子(ミュータント)の蛋白質は除外されて凝集・分解されてしまいます。ところが、そうした酵素の中に酵素機能はあるものの立体構造構築(分子フォールディング)が不安定で酵素活性が機能していないものがあります。こうした場合に、シャペロンを導入すると正常な分子フォールディングになり、ライソゾームに運ばれて、正常に機能するようになります。この花嫁介添えみたいな低分子化合物をシャペロン、それを用いた治療をシャペロン療法と呼んでいます。
ライソゾーム病の場合、酵素欠損の分子状態が一様でないことがわかっています。通常、変異分子(ミュータント)の蛋白質は除外されて凝集・分解されてしまいます。ところが、そうした酵素の中に酵素機能はあるものの立体構造構築(分子フォールディング)が不安定で酵素活性が機能していないものがあります。こうした場合に、シャペロンを導入すると正常な分子フォールディングになり、ライソゾームに運ばれて、正常に機能するようになります。この花嫁介添えみたいな低分子化合物をシャペロン、それを用いた治療をシャペロン療法と呼んでいます。
シャペロンがないと変異体はミスフォールディングして凝集分解され、ライソゾームまで到達せず酵素として機能しないが、シャペロンを導入することで、正常フォールディングされることが多くなり、ライソゾームに運ばれて、正常に機能するようになる。
ファブリー病に対するシャペロン療法
鈴木義之先生は、ファブリー病の欠損酵素で変異したα- ガラクトシダーゼA がガラクトースの存在下で安定することを発見し、さらに、ガラクトース類似体のdeoxy-galactonojirimycin(DGJ)がR301Q 変異のα- ガラクトシダーゼA を安定化し、酵素活性を8 倍に増加し、基質であるGb3 を減少させることを発見し、1999 年、NatureMedicine に報告しました。DGJ のような低分子化合物がシャペロンです。
Amicus 社はこのDGJ を経口薬、ミガラスタット塩酸塩として開発し、グラクソ・スミスクライン社と共同で2012年12 月までに第Ⅲ相試験を終了しています。
変異遺伝子の型が合わないと効果がないのが弱点ですが、感受性のある遺伝子系の患者群には有効性を示します。経口薬なので、酵素補充療法との組み合わせも期待されています。
2017 年、Journal of Medical Genetics に掲載されたフェーズⅢの報告によると、ファブリー病患者53 例に対する酵素補充療法からの変更で、腎機能、左室心筋重量、安全性及び血清Gb3 において、ミガラスタット塩酸塩は酵素補充療法と同等の効果を示すことが認められました。薬を交換した継続研究でも効果は持続したと報告されています。
一方、2017 年、The New England Journal of Medicine に掲載された報告では、ファブリー病患者67 例に対する6 ヵ月までプラセボとの二重盲検試験、その後、12 ヵ月までオープンラベルで継続投与した結果、プラセボと有意差がなかったことが認められました。
酵素補充療法とシャペロン療法の組み合わせという合わせ技も検討されました。酵素補充療法の投与2 時間前にミガラスタット塩酸塩を服用するという試験が第Ⅱ相まで実施され、感受性のある遺伝子系の患者群には有効性を示しました。ファブラザイム、リプレガルに加え、JCR ファーマ社のバイオシミラーJR-051 との組み合わせでやっていたのですが、その後GSK社が撤退してしまって進んでいないようです。医療費の問題もあるのかもしれませんが、一応、有効性はあるという状況です。
Amicus 社はこのDGJ を経口薬、ミガラスタット塩酸塩として開発し、グラクソ・スミスクライン社と共同で2012年12 月までに第Ⅲ相試験を終了しています。
変異遺伝子の型が合わないと効果がないのが弱点ですが、感受性のある遺伝子系の患者群には有効性を示します。経口薬なので、酵素補充療法との組み合わせも期待されています。
2017 年、Journal of Medical Genetics に掲載されたフェーズⅢの報告によると、ファブリー病患者53 例に対する酵素補充療法からの変更で、腎機能、左室心筋重量、安全性及び血清Gb3 において、ミガラスタット塩酸塩は酵素補充療法と同等の効果を示すことが認められました。薬を交換した継続研究でも効果は持続したと報告されています。
一方、2017 年、The New England Journal of Medicine に掲載された報告では、ファブリー病患者67 例に対する6 ヵ月までプラセボとの二重盲検試験、その後、12 ヵ月までオープンラベルで継続投与した結果、プラセボと有意差がなかったことが認められました。
酵素補充療法とシャペロン療法の組み合わせという合わせ技も検討されました。酵素補充療法の投与2 時間前にミガラスタット塩酸塩を服用するという試験が第Ⅱ相まで実施され、感受性のある遺伝子系の患者群には有効性を示しました。ファブラザイム、リプレガルに加え、JCR ファーマ社のバイオシミラーJR-051 との組み合わせでやっていたのですが、その後GSK社が撤退してしまって進んでいないようです。医療費の問題もあるのかもしれませんが、一応、有効性はあるという状況です。
他のライソゾーム病に対するシャペロン療法
ファブリー病以外のライソゾーム病に関するシャペロン療法としては、GM1 ガングリオシドーシスに対するNOEV、ゴーシェ病Ⅱ型(神経型)に対するアンブロキソール大量投与(20mg/kg)などのシャペロン療法が検討されています。
酵素補充療法の課題
2016 年現在、認可されている酵素補充製剤は10 製剤、8 疾患です。ファブリー病では、ファブラザイム(アガルシダーゼβ)とリプレガル(アガルシダーゼα)が使用されております。
この中で、ポンペ病に関しては非常に高い用量が設定されています。これは筋肉への移行性が求められているためですが、抗体もできやすいとされています。
酵素補充療法と骨髄移植の問題点を挙げてみます。酵素補充療法は、何といっても生涯にわたり点滴注射を受ける必要があります。中枢神経系に無効で、心弁膜症とか骨系統にも効果が弱い、中和抗体産生による効果減弱の可能性もあります。アナフィラキシーとかアレルギーの可能性もある。医療費の問題もあります。
骨髄移植では、ドナー確保の問題、前処置(ブスルファン、放射線など)の副作用、GVHD などの副作用の問題があるといわれています。
この中で、ポンペ病に関しては非常に高い用量が設定されています。これは筋肉への移行性が求められているためですが、抗体もできやすいとされています。
酵素補充療法と骨髄移植の問題点を挙げてみます。酵素補充療法は、何といっても生涯にわたり点滴注射を受ける必要があります。中枢神経系に無効で、心弁膜症とか骨系統にも効果が弱い、中和抗体産生による効果減弱の可能性もあります。アナフィラキシーとかアレルギーの可能性もある。医療費の問題もあります。
骨髄移植では、ドナー確保の問題、前処置(ブスルファン、放射線など)の副作用、GVHD などの副作用の問題があるといわれています。
酵素補充療法の弱点、中枢神経系への対策
中枢神経系に無効という酵素補充療法の弱点が、血液脳関門通過技術によって改善されつつあります。低分子薬剤の95%、蛋白製剤の100%が血液脳関門(BBB:Blood Brain Barrier)を通過しないといわれています。JCRファーマ社がJ-Brain Cargo という血液脳関門を通過する技術を開発しています。
J-Brain Cargo は基本的には抗トランスフェリン受容体抗体を用いた血液脳関門通過技術で、血管内皮細胞上にある複数の受容体に合わせた様々なタイプが開発されています。
東アジアで一番多いムコ多糖症Ⅱ型(ハンター病)のフェーズⅠ、Ⅱ治験が2017 年3 月から始まっています。
ポンぺ病は酸性α-グルコシダーゼ(GAA)が欠損し、心筋、骨格筋、呼吸筋などにグリコーゲンが蓄積して、筋力低下や呼吸障害を起こします。酵素補充療法を行っても効果は厳しいものがあります。そこで、J-Brain Cargo の技術を使って、酵素製剤が移行しにくい臓器の1 つである骨格筋、心筋、呼吸筋などに移行させることを目的として、前臨床試験が始まっているそうです。
さらに、ポンペ病に関しては、サノフィ・ジェンザイム社が酵素製剤のライソゾームへの取り込みの鍵となるマンノース-6- リン酸受容体の糖鎖を修飾して透過性を改善した製剤neoGAA によるNEO1 trial が2016 年に行われて、良好な効果が報告されている状況です。
J-Brain Cargo は基本的には抗トランスフェリン受容体抗体を用いた血液脳関門通過技術で、血管内皮細胞上にある複数の受容体に合わせた様々なタイプが開発されています。
東アジアで一番多いムコ多糖症Ⅱ型(ハンター病)のフェーズⅠ、Ⅱ治験が2017 年3 月から始まっています。
ポンぺ病は酸性α-グルコシダーゼ(GAA)が欠損し、心筋、骨格筋、呼吸筋などにグリコーゲンが蓄積して、筋力低下や呼吸障害を起こします。酵素補充療法を行っても効果は厳しいものがあります。そこで、J-Brain Cargo の技術を使って、酵素製剤が移行しにくい臓器の1 つである骨格筋、心筋、呼吸筋などに移行させることを目的として、前臨床試験が始まっているそうです。
さらに、ポンペ病に関しては、サノフィ・ジェンザイム社が酵素製剤のライソゾームへの取り込みの鍵となるマンノース-6- リン酸受容体の糖鎖を修飾して透過性を改善した製剤neoGAA によるNEO1 trial が2016 年に行われて、良好な効果が報告されている状況です。
遺伝子治療
遺伝子治療の2 つの方法
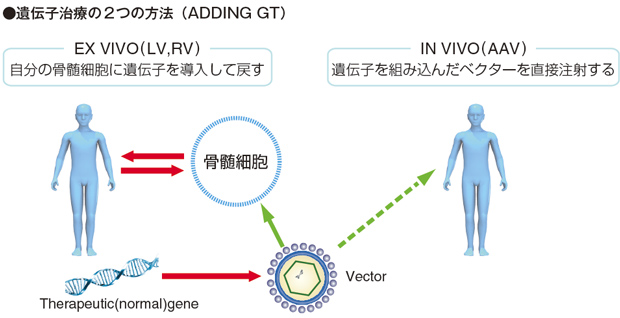
遺伝子治療では、正常に機能するTherapeutic gene をウイルスベクターに乗せて投与します。その方法にはex vivo とin vivo の2 つがあります。
ex vivo は基本的には自分の骨髄細胞に遺伝子導入して戻す自家骨髄移植の修飾型です。in vivo はウイルスベクターそのものを点滴静注します。
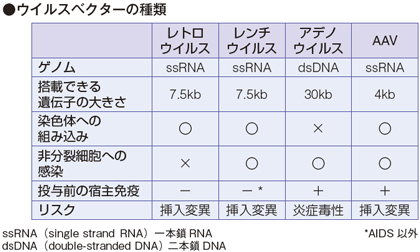
ex vivo に関してはレンチウイルス、レトロウイルス、in vivo に関してはAAV を使うことが多いとされています。
ex vivo は基本的には自分の骨髄細胞に遺伝子導入して戻す自家骨髄移植の修飾型です。in vivo はウイルスベクターそのものを点滴静注します。
ex vivo に関してはレンチウイルス、レトロウイルス、in vivo に関してはAAV を使うことが多いとされています。
遺伝子治療の成功例
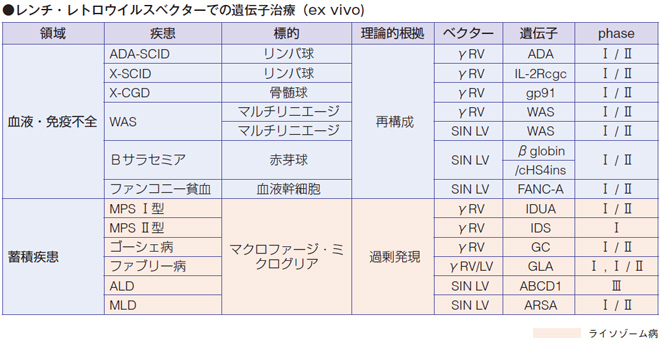
世界で初めての遺伝子治療が承認されたのは、ライソゾーム病ではありません。LPL(リポ蛋白リパーゼ)欠損症という病気です。LPL はトリグリセリドの加水分解酵素で、欠損により高カイロミクロン血症などを起こすのですが、酵素遺伝子を組み込んだAAV1 ベクターを筋注することによって、症状が非常に改善していきます。
また、副腎白質ジストロフィー(ALD)は、ペルオキシソームのALDP という膜輸送蛋白の障害で脱髄が起きてしまう病気です。2009 年にフランスの治験で、骨髄移植のドナーが見つからない7 歳のALD 患者に遺伝子治療を行ったところ、進行をとめることができました。
また、副腎白質ジストロフィー(ALD)は、ペルオキシソームのALDP という膜輸送蛋白の障害で脱髄が起きてしまう病気です。2009 年にフランスの治験で、骨髄移植のドナーが見つからない7 歳のALD 患者に遺伝子治療を行ったところ、進行をとめることができました。
ライソゾー病に対する遺伝子治療
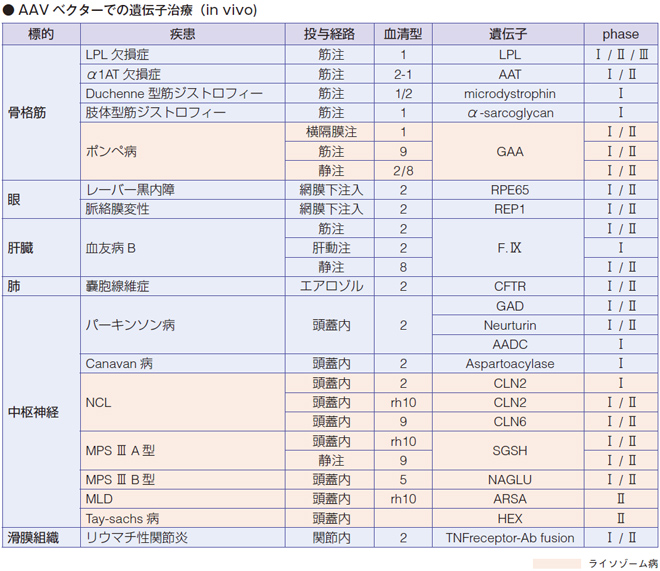
ライソゾーム病ではポンペ病、神経セロイドリポフスチン症(NCL)、ムコ多糖症、テイ= サックス(GM2 ガングリオシドーシス)がin vivo による治験に入っています。
LYSOGENE 社が、ムコ多糖症ⅢA 型(サンフィリッポA 型)に関してAAV の開発を行い、血清型、自由型の脳内注射でフェーズⅡまで来ているそうです。
さらに、レトロウイルス、レンチウイルスを使ったex vivo の自家骨髄移植方法が、ムコ多糖症Ⅰ・Ⅱ型、ゴーシェ病、ファブリー病、MLD で治験が行われています。
異染性白質ジストロフィー(MLD)はArylsulfatase A の欠損によるスルファドの蓄積で進行が早く、骨髄移植の効果も厳しく、しかも、酵素補充療法がない病気です。後期若年型発症の同胞を持つ未発症の患者さんに対してMLD をex vivo で遺伝子治療を行った場合、正常な機能をほぼintact にキープでき、ALD を上回る発症予防ができている状況になっています。
ムコ多糖症モデルマウスを使って、レンチウイルスによるex vivo 遺伝子治療を行った結果、血清IDS 酵素活性が15 倍ぐらいに上昇しキープできることが判明しました。骨髄移植に優る効果が期待できるのではないかということで、各会社が今、ALD とかサンフィリッポで治験を開始しています。
ファブリー病については、AVROBIO 社がレンチウイルスによる遺伝子治療を開発し、現在フェーズⅡから国際共同治験に入るところです。
LYSOGENE 社が、ムコ多糖症ⅢA 型(サンフィリッポA 型)に関してAAV の開発を行い、血清型、自由型の脳内注射でフェーズⅡまで来ているそうです。
さらに、レトロウイルス、レンチウイルスを使ったex vivo の自家骨髄移植方法が、ムコ多糖症Ⅰ・Ⅱ型、ゴーシェ病、ファブリー病、MLD で治験が行われています。
異染性白質ジストロフィー(MLD)はArylsulfatase A の欠損によるスルファドの蓄積で進行が早く、骨髄移植の効果も厳しく、しかも、酵素補充療法がない病気です。後期若年型発症の同胞を持つ未発症の患者さんに対してMLD をex vivo で遺伝子治療を行った場合、正常な機能をほぼintact にキープでき、ALD を上回る発症予防ができている状況になっています。
ムコ多糖症モデルマウスを使って、レンチウイルスによるex vivo 遺伝子治療を行った結果、血清IDS 酵素活性が15 倍ぐらいに上昇しキープできることが判明しました。骨髄移植に優る効果が期待できるのではないかということで、各会社が今、ALD とかサンフィリッポで治験を開始しています。
ファブリー病については、AVROBIO 社がレンチウイルスによる遺伝子治療を開発し、現在フェーズⅡから国際共同治験に入るところです。
まとめ
遺伝子治療は、Editing Gene Therapy(編集遺伝子治療)の話題もありますが、今回は省略します。
以上のように、ライソゾーム病の治療は、基質合成阻害剤、シャペロン、酵素補充療法、遺伝子治療という状況で開発が進んでいるわけです。
以上のように、ライソゾーム病の治療は、基質合成阻害剤、シャペロン、酵素補充療法、遺伝子治療という状況で開発が進んでいるわけです。