ゴーシェ病の診断アルゴリズムによる早期診断
早期診断への取り組みについて、ゴーシェ病からお話します。
神経症状を伴わないゴーシェ病Ⅰ型の患者さんは海外に多く、海外では診断アルゴリズムが作られています。そのプロトコールは基本的に「脾腫がある」、「血小板が少ない(15万/ µ l 未満)」を手がかりに、酵素活性を測定するというものです。
Mottaらの報告によれば、脾腫または血小板減少を有する患者さん196名で調べた結果、ゴーシェ病患者さんが7名(有病率3.6%)診断されました。少し多い様にも思いますが、こうした診断アルゴリズムで患者さんが見つかってくる可能性があります。
神経症状を伴わないゴーシェ病Ⅰ型の患者さんは海外に多く、海外では診断アルゴリズムが作られています。そのプロトコールは基本的に「脾腫がある」、「血小板が少ない(15万/ µ l 未満)」を手がかりに、酵素活性を測定するというものです。
Mottaらの報告によれば、脾腫または血小板減少を有する患者さん196名で調べた結果、ゴーシェ病患者さんが7名(有病率3.6%)診断されました。少し多い様にも思いますが、こうした診断アルゴリズムで患者さんが見つかってくる可能性があります。
ゴーシェ病診断の手掛かりとなる症状・検査
ゴーシェ病Ⅰ型の患者さんでは、皮下出血、脾腫、肝腫大、骨痛などの症状、血小板減少、フェリチン上昇、ACE上昇などの検査値異常が発症時にみられることが特徴的です。
実際には、肝脾腫、出血傾向、反復性骨痛などの臨床症状を調べ、検査値の異常として血小板減少、ACP(今は保険適用外、日常的に使うことは難しい)、ACEを測定します。
Ⅱ型、Ⅲ型の患者さんでは、神経症状、眼球運動異常が特徴的です。
これらの臨床症状、検査値の異常が認めたれたら、ゴーシェ病の確定診断のための検査として、グルコセレブロシダーゼ酵素活性を測定します。
ただ、保険適用ですが、遺伝学的検査として3880点です。診断がついていないと、指定難病にならないので、成人の患者さんだと3割自己負担になります。つまり、「約1万円を払って検査をしますか」という非常に高いハードルになるわけです。
遺伝子解析も可能ですけれども、これも酵素活性で診断がついた症例に限って行われているということが現状です。
骨髄穿刺も、気軽にできる検査ではないということなので、診断のプロセスをいかに簡便にしていくかということが重要だと思います。
それで、最近はろ紙血を使った酵素活性を簡便にはかるという方法で診断を進めていくことが広まってきています。
実際には、肝脾腫、出血傾向、反復性骨痛などの臨床症状を調べ、検査値の異常として血小板減少、ACP(今は保険適用外、日常的に使うことは難しい)、ACEを測定します。
Ⅱ型、Ⅲ型の患者さんでは、神経症状、眼球運動異常が特徴的です。
これらの臨床症状、検査値の異常が認めたれたら、ゴーシェ病の確定診断のための検査として、グルコセレブロシダーゼ酵素活性を測定します。
ただ、保険適用ですが、遺伝学的検査として3880点です。診断がついていないと、指定難病にならないので、成人の患者さんだと3割自己負担になります。つまり、「約1万円を払って検査をしますか」という非常に高いハードルになるわけです。
遺伝子解析も可能ですけれども、これも酵素活性で診断がついた症例に限って行われているということが現状です。
骨髄穿刺も、気軽にできる検査ではないということなので、診断のプロセスをいかに簡便にしていくかということが重要だと思います。
それで、最近はろ紙血を使った酵素活性を簡便にはかるという方法で診断を進めていくことが広まってきています。
ゴーシェ病のハイリスクスクリーニング
ゴーシェ病のハイリスクスクリーニングについてお話します。ハイリスクスクリーニングの対象となる診療科は、小児神経領域または神経内科、血液内科領域と考えています。
我々は小児神経領域で、診断のつかないけいれん、眼球運動異常などを示す患者さん100人を調査し、2名のゴーシェ病患者さんが見つかったことを最近報告しています。
その症例を紹介します。この患児は、生後3ヵ月頃から嚥下障害、体重増加不良、異常眼球運動、内斜視、項部硬直を認めました。Hbや血小板の低値があり、エコーにて肝脾腫も認めました。実際に依頼を受け診断されたのは生後9カ月になってからです。やはり症状が出始めてから診断に至るまでどうしても時間がかかるのだろうと考えています。酵素活性もGBA 活性0.3 (pmol/h/disk) と低値で、遺伝子異常として、c.999+1G>Tのスプライス異常とL444Pのコンパウンドヘテロでした。
我々は小児神経領域で、診断のつかないけいれん、眼球運動異常などを示す患者さん100人を調査し、2名のゴーシェ病患者さんが見つかったことを最近報告しています。
その症例を紹介します。この患児は、生後3ヵ月頃から嚥下障害、体重増加不良、異常眼球運動、内斜視、項部硬直を認めました。Hbや血小板の低値があり、エコーにて肝脾腫も認めました。実際に依頼を受け診断されたのは生後9カ月になってからです。やはり症状が出始めてから診断に至るまでどうしても時間がかかるのだろうと考えています。酵素活性もGBA 活性0.3 (pmol/h/disk) と低値で、遺伝子異常として、c.999+1G>Tのスプライス異常とL444Pのコンパウンドヘテロでした。
ゴーシェ病の早期診断の利点
ゴーシェ病の早期診断の利点は、まず、
- 全身症状が改善することです。特に、肝脾腫、貧血、血小板減少や骨症状に対して酵素補充療法の効果が認められます。また、
- Ⅰ型では大腿骨頭壊死、多発骨折、骨密度の低下などの骨症状に対して早期治療の効果が認められ、骨症状を予防することが、生涯にわたるQOL に対しては効果が高い1つと考えています。
- Ⅱ型、Ⅲ型ではご存じのとおり、神経症状への治療効果は限られますが、全身症状が改善することで神経症状が軽減されることにつながっている可能性もあります。それから、シャペロン療法などの神経症状を改善する可能性がある治療法が提案されています。シャペロン療法ではミオクローヌスが軽減するということで、神経症状に対する有効性が指摘されています。
ファブリー病の臨床症状と最近の治療
次にファブリー病についてお話しします。ファブリー病はいろいろな臨床症状が、時期を変えて発症します。小児期に目立ってくるような四肢の末端痛、発汗障害といった初期症状と、成人期の腎機能障害、心機能障害、脳血管障害などの後期の重症症状があり、成人期での診断がファブリー病の診断になかなか繋がらないことが診断の難しさだと考えています。
ファブリー病の発症と診断時期は10年以上かかることも報告されています。
酵素補充療法等の治療は痛みに対しては、効く症例とあまり効果がない症例があります。発汗障害、消化器症状は比較的改善することが多い症状とされています。
ただ、心臓の症状では、治療の開始時期が遅れると、酵素補充治療を開始したときに心臓の線維化が既に起こっている場合が多く、治療効果は限定的となります。それだけ早期診断が重要となります。
それから、ファブリー病では最近、分子シャペロン療法という内服治療が行われるようになりました。特定の遺伝子変異を持つ患者さんの酵素活性を上昇させ、尿中Gb3の低下、心機能、腎機能の回復などの効果が報告されています。治療の選択肢も増えています。
ファブリー病の発症と診断時期は10年以上かかることも報告されています。
酵素補充療法等の治療は痛みに対しては、効く症例とあまり効果がない症例があります。発汗障害、消化器症状は比較的改善することが多い症状とされています。
ただ、心臓の症状では、治療の開始時期が遅れると、酵素補充治療を開始したときに心臓の線維化が既に起こっている場合が多く、治療効果は限定的となります。それだけ早期診断が重要となります。
それから、ファブリー病では最近、分子シャペロン療法という内服治療が行われるようになりました。特定の遺伝子変異を持つ患者さんの酵素活性を上昇させ、尿中Gb3の低下、心機能、腎機能の回復などの効果が報告されています。治療の選択肢も増えています。
日本で行われているライソゾーム病の酵素補充療法と早期診断
いろいろなライソゾーム病に対し酵素補充治療ができるようになってきました。それに伴い治療できる疾患を早く見つける早期診断の重要性が高まっています。
ライソゾーム病の早期診断の利点としては、
ライソゾーム病の早期診断の利点としては、
- 確定診断前の不要な受診や検査の繰り返しを避けられること
- 不可逆的な症状の発症前に治療を開始できること
- 疾患の専門施設への相談が容易になること
- 診断後の支援体制が期待できること
があげられます。
ライソゾーム病では、ろ紙血を用いた酵素活性測定を行っています。タンデムマスを用いたいわゆるマルチプレックスの酵素活性測定法、蛍光基質4MUを用いた測定方法などがあります。
ライソゾーム病では、ろ紙血を用いた酵素活性測定を行っています。タンデムマスを用いたいわゆるマルチプレックスの酵素活性測定法、蛍光基質4MUを用いた測定方法などがあります。
ライソゾーム病の診断とスクリーニング
ライソゾーム病をスクリーニングする場合、一般診療における診断のほかに、ハイリスクのスクリーニング、マススクリーニングが可能になっています。
ハイリスクスクリーニングでは、ライソゾーム病を疑うきっかけがあり、何らかの特定の症状や検査値異常を持つ方全員の酵素活性を測定して診断を進めていきます。
マススクリーニングでは、何も疑うきっかけはなく、新生児など全員の酵素活性を測定する方法です。
ハイリスクスクリーニングでは、ライソゾーム病を疑うきっかけがあり、何らかの特定の症状や検査値異常を持つ方全員の酵素活性を測定して診断を進めていきます。
マススクリーニングでは、何も疑うきっかけはなく、新生児など全員の酵素活性を測定する方法です。
ハイリスクスクリーニングの仕組み
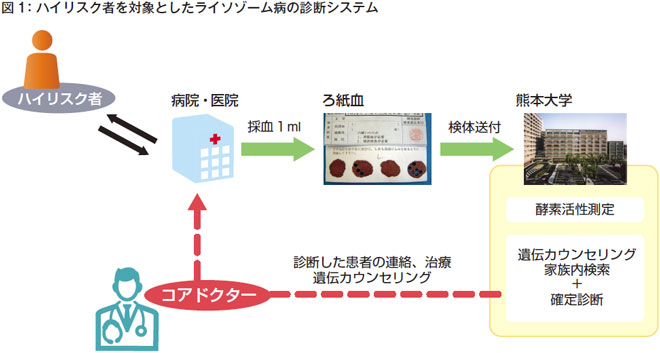
ハイリスクスクリーニングでは、まず病院・医院でハイリスク者から採血しろ紙血検体を作ります。それを熊本大学に送っていただいて酵素活性を測定します。疑いがある場合には遺伝子解析、家族解析などを行うこともできますし、地域の専門医(コアドクター)を紹介することもできるという仕組みを作っています(図1)。
ファブリー病、ポンペ病、ゴーシェ病、ムコ多糖症、酸性リパーゼ欠損症(LALD)などの治療可能な疾患で、これら疾患に特徴的な臨床症状または検査値異常を手がかりに早期診断を進めていくことを行っています。
ファブリー病、ポンペ病、ゴーシェ病、ムコ多糖症、酸性リパーゼ欠損症(LALD)などの治療可能な疾患で、これら疾患に特徴的な臨床症状または検査値異常を手がかりに早期診断を進めていくことを行っています。
新生児スクリーニングの仕組み
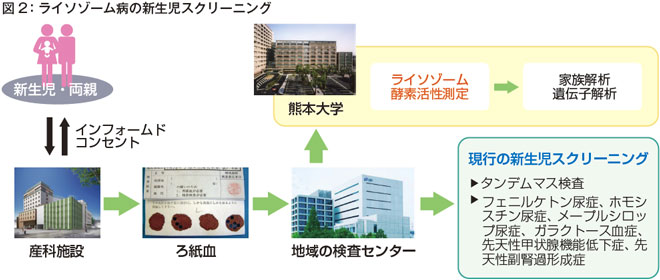
熊本大学では新生児のスクリーニングも同時に行っています(図2)。我々のライソゾーム病の新生児スクリーニングでは、タンデムマス検査を初めとした多疾患の新生児スクリーニングに乗せて、同じ検体でライソゾーム病の酵素活性を測定するという方法で実施しています。
ライソゾーム病はいろいろな時期に発症するため、それぞれの時期に採血して検査することも可能です。しかし、今のところ、新生児期以外に全員を採血して検査することができないことと、新生児期に酵素活性を測定することで早期診断を進めることができるため、新生児期のスクリーニングを進めています。
現在、熊本では、対象疾患として、ファブリー病、ポンペ病、ゴーシェ病、ムコ多糖症Ⅰ型、Ⅱ型の新生児スクリーニングを実施しています。福岡、山口の一部の地域でファブリー病とポンぺ病、愛知でポンペ病と原発性免疫不全症の新生児期スクリーニングが行われています。最近では埼玉や千葉でも、一部の病院で、ファブリー病、ポンペ病とムコ多糖症Ⅰ型の新生児スクリーニングが始まっているところです。
ライソゾーム病はいろいろな時期に発症するため、それぞれの時期に採血して検査することも可能です。しかし、今のところ、新生児期以外に全員を採血して検査することができないことと、新生児期に酵素活性を測定することで早期診断を進めることができるため、新生児期のスクリーニングを進めています。
現在、熊本では、対象疾患として、ファブリー病、ポンペ病、ゴーシェ病、ムコ多糖症Ⅰ型、Ⅱ型の新生児スクリーニングを実施しています。福岡、山口の一部の地域でファブリー病とポンぺ病、愛知でポンペ病と原発性免疫不全症の新生児期スクリーニングが行われています。最近では埼玉や千葉でも、一部の病院で、ファブリー病、ポンペ病とムコ多糖症Ⅰ型の新生児スクリーニングが始まっているところです。
ライソゾーム病のスクリーニング(熊本大学の取り組み)
熊本大学では、ファブリー病の新生児スクリーニングを2006年から始めていて、古典型の患者さんが8 名診断されています。このうちの少なくとも4名は既に治療が始まっています。
それから、ポンペ病を18万人調査し、まだ患者さんは見つかっていません。ハイリスクスクリーニングでは、ゴーシェ病患者100人を調査して2人、さらに150人まで調査して3名の患者さんが見つかっています。成人例も1人診断がついています。
それから、ポンペ病を18万人調査し、まだ患者さんは見つかっていません。ハイリスクスクリーニングでは、ゴーシェ病患者100人を調査して2人、さらに150人まで調査して3名の患者さんが見つかっています。成人例も1人診断がついています。
新生児スクリーニングを契機に家族のファブリー病が診断されたケース
表1は新生児スクリーニングを契機に家族のファブリー病が診断されたケースです。新生児スクリーニングで診断されたファブリー病の古典型の男児です。3歳くらいから熱が出たときに手足の痛みを訴えるようになり、夏に汗をかきにくくなりで、小学校に入った時から酵素補充療法を始めています。
実は、この男児のお母さんと叔母さんは、後で振り返ると典型的なファブリー病の症状が考えられて、お母さんは手足の痛み、自律神経障害、叔母さんは運動で増強する手足の痛みが現れていたのですが診断はついておらず、この男児の診断をきっかけに家族のファブリー病の診断が進みました。
実は、この男児のお母さんと叔母さんは、後で振り返ると典型的なファブリー病の症状が考えられて、お母さんは手足の痛み、自律神経障害、叔母さんは運動で増強する手足の痛みが現れていたのですが診断はついておらず、この男児の診断をきっかけに家族のファブリー病の診断が進みました。
公費負担タンデムマス検査の導入とその課題
こういった新規のスクリーニングを進めていく上で課題というものがあると考えています。例えば、最近タンデムマス検査が全国で一斉に始まったのですけれども、平成25年までにタンデムマス検査を開始するあるいは計画している地域とまだ始まっていない地域が混在しています。
代謝異常の専門医の有無がこうした地域差となっている可能性もあります。検査が開始していない地域で、患者さんが見つかった場合、どのようにフォローするのか、体制作りにも課題があると考えています。全国津々浦々で同じようなスクリーニングを行っていくためには、たくさんの課題があるわけです。
代謝異常の専門医の有無がこうした地域差となっている可能性もあります。検査が開始していない地域で、患者さんが見つかった場合、どのようにフォローするのか、体制作りにも課題があると考えています。全国津々浦々で同じようなスクリーニングを行っていくためには、たくさんの課題があるわけです。
スクリーニング導入時の課題(聴覚スクリーニングを例示)
1つ思い出すのが聴覚スクリーニングです。聴覚スクリーニングは2001年からモデル事業として始められています。最近では補助が出る自治体が少しずつ出てきていますが、有料の検査として行われています。
簡単な検査で異常がわかって、スクリーニングの効果は高く、早期支援(療育・教育)が可能になって、獲得語彙数が小学校入学時には2倍の差があるといわれています。
非常に効果が高い検査ですが、スクリーニングが始まってしばらくの時期は、「発見」後の支援が不十分な時期があったことが反省点として挙げられています。
異常ありの新生児の診断が耳鼻科で確定するのは生後3ヵ月頃です。5ヵ月頃までに補聴器などの治療や手話の療育が開始されます。しかし、検査で異常ありの結果報告時も、その後どうなるのか説明がされていなかった地域がありました。
そうすると、耳が聞こえないかもしれないと言われたまま、3ヵ月過ごさないとならず、それが非常につらかったということが問題点として挙げられていました。
重要なスクリーニングでも、支援の体制をきちんとつくっていかないと、いろいろな課題を残してしまうという1つの例だと思います。
簡単な検査で異常がわかって、スクリーニングの効果は高く、早期支援(療育・教育)が可能になって、獲得語彙数が小学校入学時には2倍の差があるといわれています。
非常に効果が高い検査ですが、スクリーニングが始まってしばらくの時期は、「発見」後の支援が不十分な時期があったことが反省点として挙げられています。
異常ありの新生児の診断が耳鼻科で確定するのは生後3ヵ月頃です。5ヵ月頃までに補聴器などの治療や手話の療育が開始されます。しかし、検査で異常ありの結果報告時も、その後どうなるのか説明がされていなかった地域がありました。
そうすると、耳が聞こえないかもしれないと言われたまま、3ヵ月過ごさないとならず、それが非常につらかったということが問題点として挙げられていました。
重要なスクリーニングでも、支援の体制をきちんとつくっていかないと、いろいろな課題を残してしまうという1つの例だと思います。
重症複合免疫不全症(SCID)の新生児スクリーニング
最近、重症複合免疫不全症(SCID)の新生児スクリーニングが、方法論的には確立しています。愛知県では県全体で行うということで、今、同意されている患者さんが全県の新生児の半分を超えました。愛知は出生数は年間6万人程だそうで、3万人を超えたということになります。
これを熊本でも新規のスクリーニングとして来年から取り入れていこうということで準備を進めています。この検査でいろんな疾患が見つかってきます。重症度もすごく異なり、治療が必要な疾患、そうでない疾患を説明していく必要があります。先天代謝異常症ではありませんが大事なスクリーニングです。例えば、生ワクチンを受ける前に免疫不全を見つける必要があるという説明をすると、産科の先生は、それは大事な検査だと理解してくれるようなスクリーニングです。そういうスクリーニング検査は今後、ますます広まっていく可能性があると考えています。
これを熊本でも新規のスクリーニングとして来年から取り入れていこうということで準備を進めています。この検査でいろんな疾患が見つかってきます。重症度もすごく異なり、治療が必要な疾患、そうでない疾患を説明していく必要があります。先天代謝異常症ではありませんが大事なスクリーニングです。例えば、生ワクチンを受ける前に免疫不全を見つける必要があるという説明をすると、産科の先生は、それは大事な検査だと理解してくれるようなスクリーニングです。そういうスクリーニング検査は今後、ますます広まっていく可能性があると考えています。
低ホスファターゼ症(HPP)の新生児スクリーニング
低ホスファターゼ症(HPP)は組織非特異的アルカリホスファターゼ(ALP)が欠損する疾患で、早期診断で酵素補充療法による改善が可能になってきています。この疾患もいろいろな重症度があります。超重症型というのは胎児エコーで診断できます。NICUに入るぐらいの子はアルカリホスファターゼを必ずはかります。そうではない子でも、くる病様の変化が進んでいく。成人期に骨の痛みを繰り返す方が、実際には低ホスファターゼ症だという方もいらして、そういう方を新生児期に見つけて必要な時期に治療することも、考え方としては1つあるのではないかということで、今、この準備を進めているところです。
脊髄性筋委縮症(SMA)1 型の治療とスクリーニング
先ほど島津先生からお話があった脊髄性筋委縮症(SMA)1 型は、治療ができるようになりました。ただ、生後すぐに見つけて治療することが治療効果としては一番高いと考えられています。
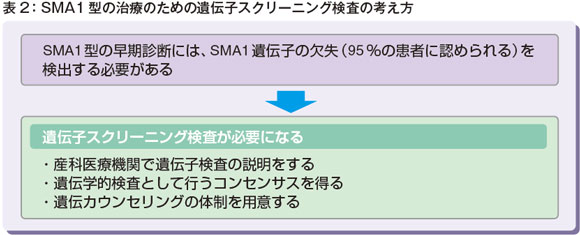
ただ、今それが可能なのは兄弟例だけです。ですから、新生児期にスクリーニングをする必要があります。SMA1型の患者さんは、95%がSMA1遺伝子の欠失があるということで、神戸大学にいらした西尾久英先生が、遺伝子スクリーニング検査が必要になるということでその方法を確立されています。
新生児でスクリーニングすることが、いちばん効果が期待できますが、遺伝子スクリーニングを新生児期に行うことの難しさはあるだろうと思います。
1つは産科医療機関で遺伝子検査の説明をして、同意をもらって検査することになります。助産師さんに遺伝子検査の説明と同意を求めるというのは、やはりなかなか大変なことかもしれません。
ただ、これは遺伝学的検査として考える必要があると私は考えています(表2)。つまり、酵素活性やフェニルアラニンを測るというのも遺伝学的検査なのですけれども、治療的意義が確立した遺伝学的検査として「遺伝子欠失を調べる」ということで、遺伝カウンセリング体制を用意する必要はあっても、遺伝カウンセリングすることが必須ではないという検査に当たるだろうと考えています。だから、産科で助産師さんが説明しやすいようなツールをつくって理解を得られれば、「遺伝子を調べるというスクリーニング」も可能になるのではないかと考えています。
遺伝カウンセリングとしては、遺伝子の欠失をいつ検査するのが患者さんにとって一番利益があるのかいう観点から考える必要があり、その答えとして新生児期にスクリーニングをするべきだという考え方になると考えています。
ファブリー病などのX連鎖性の遺伝形式ではよくありますが、親御さんが罪悪感を持ってしまうようなこともあるので、検査できる疾患、調べる必要がある疾患だけを調べるということをきちんと理解していただくことも大事だと考えています。
ただ、今それが可能なのは兄弟例だけです。ですから、新生児期にスクリーニングをする必要があります。SMA1型の患者さんは、95%がSMA1遺伝子の欠失があるということで、神戸大学にいらした西尾久英先生が、遺伝子スクリーニング検査が必要になるということでその方法を確立されています。
新生児でスクリーニングすることが、いちばん効果が期待できますが、遺伝子スクリーニングを新生児期に行うことの難しさはあるだろうと思います。
1つは産科医療機関で遺伝子検査の説明をして、同意をもらって検査することになります。助産師さんに遺伝子検査の説明と同意を求めるというのは、やはりなかなか大変なことかもしれません。
ただ、これは遺伝学的検査として考える必要があると私は考えています(表2)。つまり、酵素活性やフェニルアラニンを測るというのも遺伝学的検査なのですけれども、治療的意義が確立した遺伝学的検査として「遺伝子欠失を調べる」ということで、遺伝カウンセリング体制を用意する必要はあっても、遺伝カウンセリングすることが必須ではないという検査に当たるだろうと考えています。だから、産科で助産師さんが説明しやすいようなツールをつくって理解を得られれば、「遺伝子を調べるというスクリーニング」も可能になるのではないかと考えています。
遺伝カウンセリングとしては、遺伝子の欠失をいつ検査するのが患者さんにとって一番利益があるのかいう観点から考える必要があり、その答えとして新生児期にスクリーニングをするべきだという考え方になると考えています。
ファブリー病などのX連鎖性の遺伝形式ではよくありますが、親御さんが罪悪感を持ってしまうようなこともあるので、検査できる疾患、調べる必要がある疾患だけを調べるということをきちんと理解していただくことも大事だと考えています。
小児難病早期診断の支援体制の重要性
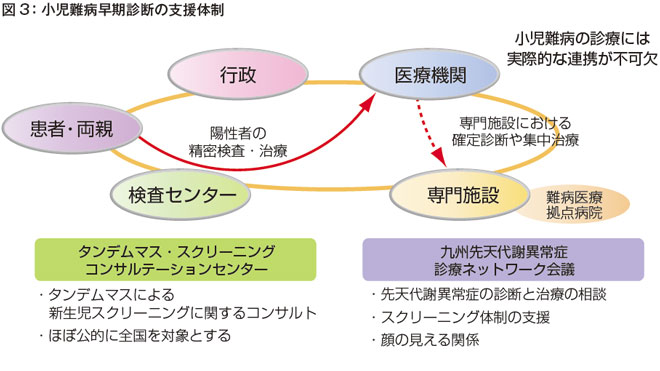
小児難病に対し早期診断をしていくというのは、ただ見つけて、「患者さんです、治療しましょう」という話ではなくて、先生方も今日のお話の中で「連携」という言葉を使っていらっしゃいましたけれども、いろんな機関との連携が大切だろうと考えています(図3)。
島津先生が言われた「顔が見える関係」を地域でつくっていくというのは、非常に重要なことだと思います。必要な病気を早く見つけて、それを患者さんに役立てていただくということを目指していく中で、ライソゾーム病だけではなくて、それ以外の疾患の新生児スクリーニング、ハイリスクスクリーニングといった早期診断の体制をきちんとつくっていくことが大切だと考えているところです。
島津先生が言われた「顔が見える関係」を地域でつくっていくというのは、非常に重要なことだと思います。必要な病気を早く見つけて、それを患者さんに役立てていただくということを目指していく中で、ライソゾーム病だけではなくて、それ以外の疾患の新生児スクリーニング、ハイリスクスクリーニングといった早期診断の体制をきちんとつくっていくことが大切だと考えているところです。
中村先生の質疑応答は「総合討論」をご参照ください。