在宅医療をはじめ、諸問題がライソゾーム病の周辺でも起きています。私はゴーシェ病を題材にして、今の日本の問題、診療と治療の現状についてお話ししたいと思います。
ゴーシェ病の臨床病型
ゴーシェ病の臨床病型は、Ⅰ型、Ⅱ型、Ⅲ型に分類されています。
- Ⅰ型は非神経型で、神経症状はありません。発症時期は、乳幼児期から成人期と非常にバリエーションに富んでいて、肝脾腫も骨症状も異所性が強い病型です。
- Ⅱ型は神経症状が非常に強くて、発症は乳児期。肝脾腫は余り目立たず、骨症状も原則的にありません。
- Ⅲ型は神経症状を呈するのですが、Ⅱ型に比べてマイルドで、発症時期も乳児ではなくて少し遅れて乳幼児から学童期です。肝脾腫があり、骨症状は有無いずれもあります。
以上のように異質性が強いというのが、ゴーシェ病の特徴です。
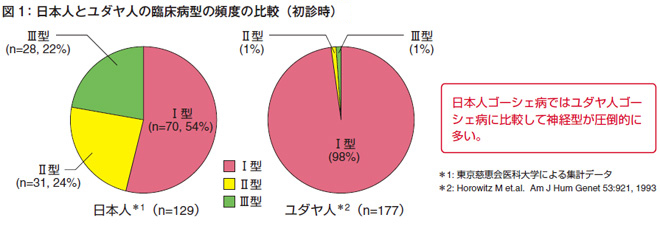
日本人とユダヤ人の病型の比較
特に、日本人では、臨床病型の頻度がユダヤ人と全く異なるという特徴があります。ユダヤ人はⅠ型(非神経型)が主な病型で、神経型はほとんど見られません。それに対して、日本人は約半分が神経型です(図1)。これが一番大きな問題です。
もう1つの特徴は、ユダヤ人のⅠ型に比べて症状が重いことです。ユダヤ人では成人期に発症しますが、日本人では小児期に発症します。日本人の場合、非常に巨大な脾腫を呈するので、摘出率が高く約6割です。今は酵素補充療法があるので、脾摘する方は少ないですけれども、酵素補充療法が開発される前は脾摘率が非常に高値でした。骨合併率も、ユダヤ人では10%ですが、日本人では約40%の患者さんで明らかな骨合併症を呈しています。重症度スコアも、ユダヤ人では10.7ポイントに対して日本人では12.8でした。
もう1つの特徴は、ユダヤ人のⅠ型に比べて症状が重いことです。ユダヤ人では成人期に発症しますが、日本人では小児期に発症します。日本人の場合、非常に巨大な脾腫を呈するので、摘出率が高く約6割です。今は酵素補充療法があるので、脾摘する方は少ないですけれども、酵素補充療法が開発される前は脾摘率が非常に高値でした。骨合併率も、ユダヤ人では10%ですが、日本人では約40%の患者さんで明らかな骨合併症を呈しています。重症度スコアも、ユダヤ人では10.7ポイントに対して日本人では12.8でした。
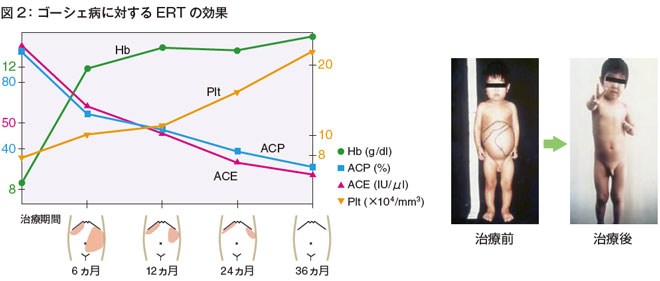
このように日本人ゴーシェ病はユニークな臨床表現型を呈します。現在、酵素補充療法がゴーシェ病の治療として実地臨床で行われています。その効果を図2 に示します。グリーンのラインで示すHbは、治療開始後約6ヵ月で12g/dl まで上昇して、貧血の改善は非常によいことがわかります。そして治療前の血小板数は約8万でしたが、約3年で正常値になり、肝脾腫も、約3年でほとんど消失しています。
日本人ゴーシェ病の特徴と酵素補充療法の問題点
以上のことから日本人ゴーシェ病の特徴は、
- 神経型の頻度が高い。
- Ⅰ型でも重症型の頻度が高い。
と言えます。
一方、酵素補充療法の問題点としては、
一方、酵素補充療法の問題点としては、
- 高分子たんぱく製剤のため、脳血管関門(BBB)を通過できない。したがって、中枢神経症状に効果が乏しい。
神経型が多い日本人においては、これが非常に大きな問題です。さらに、
- 定期的に病院に来院して、2週間ごとに点滴静注を受ける必要がある。
酵素補充療法は、原則的に在宅の治療が認められません。したがって、脳血液関門を通過する、そして、経口投与が可能な低分子薬が、これらの課題を解決する可能性があるということで、最近低分子薬についての開発が進んでいます。
神経型ゴーシェ病に対するムコソルバン®を用いた化学シャペロン療法
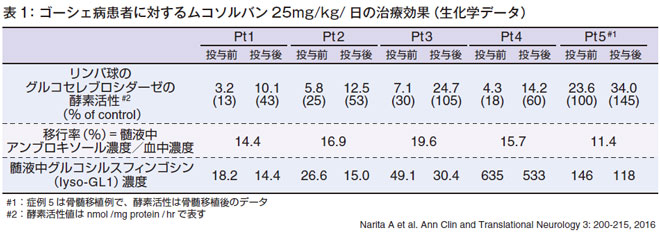
鳥取大学脳神経小児科の成田綾先生は、神経型ゴーシェ病患者5例に対する経口薬ムコソルバンを使ったシャペロン療法について2016年に報告されています(表1、図3)。
シャペロン療法の効果は遺伝子型に依存し、N188SあるいはF213I などの遺伝子変異に効果があります。この研究の対象はⅡ型あるいはⅢ型で、ADLは大体寝たきりか車椅子の患者さんです。
シャペロン療法の効果は遺伝子型に依存し、N188SあるいはF213I などの遺伝子変異に効果があります。この研究の対象はⅡ型あるいはⅢ型で、ADLは大体寝たきりか車椅子の患者さんです。
- グルコセレブロシダーゼの酵素活性(表1)
ムコソルバンを去痰剤として用いる場合の投与量は通常1mg/kg/日ですが、ゴーシェ病の場合は最終的に25mg/kg/日を投与します。治療開始時は低投与量でスタートし、副反応を見ながら漸増していきます。
ムコソルバン投与により、リンパ球のグルコセレブロシダーゼの酵素活性が、1番の患者さん(Pt1)では3.2 から10.1と正常の43%ぐらいまで上昇しています。2番の患者さん(Pt2)では53%上昇、3番の患者さん(Pt3)では正常よりも多い酵素活性、4 番の患者さん(Pt4)でも60%上昇、5 番の患者さん(Pt5)は骨髄移植例なので初めから酵素活性が上がっていますがさらに上昇しています。以上のようにムコソルバンを投与するとグルコセレブロシダーゼ活性が正常の40%以上に上昇します。
ムコソルバン投与により、リンパ球のグルコセレブロシダーゼの酵素活性が、1番の患者さん(Pt1)では3.2 から10.1と正常の43%ぐらいまで上昇しています。2番の患者さん(Pt2)では53%上昇、3番の患者さん(Pt3)では正常よりも多い酵素活性、4 番の患者さん(Pt4)でも60%上昇、5 番の患者さん(Pt5)は骨髄移植例なので初めから酵素活性が上がっていますがさらに上昇しています。以上のようにムコソルバンを投与するとグルコセレブロシダーゼ活性が正常の40%以上に上昇します。
- 髄液中への移行率(表1)
ムコソルバンが単に酵素活性を上げるだけではなくて、中枢神経系に移行するかどうかが問題ですが、血中のレベルと髄液中のレベルを比べてみますと、血中の11~20%のムコソルバンが髄液中に移行しています。
- 髄液中のグルコシルスフィンゴシン(lyso-GL1)(表1)
中枢神経症状のバイオマーカーであるグルコシルスフィンゴシン(lyso-GL1)のレベルも、患者さんによってかなりバリエーションがありますけれども、治療により全例で下がっています。
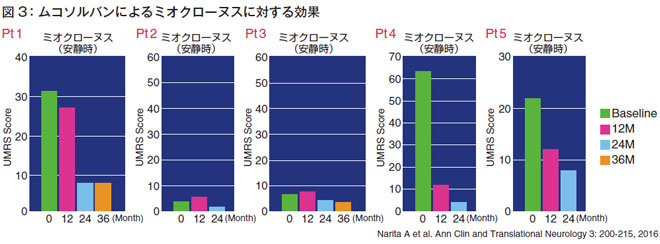
- ミオクローヌスに対する効果(図3)
UMRSスコアが高ければミオクローヌスが強いのですが、特にミオクローヌスが強い1番の患者さん、4番の患者さん、5番の患者さんでは、治療によりUMRS スコアが改善しており、ミオクローヌスに対して効果があることがわかります。
ゴーシェ病に対する基質合成抑制療法(SRT)
- エリグルスタットの日本における効能と使用上の注意
もう1つの経口治療薬、エリグルスタット(サデルガ®)がゴーシェ病治療薬として、2015年、日本で承認されました。本剤は基質合成抑制薬で、作用機序がシャペロンと異なります。貧血、血小板減少、肝脾腫に効果がありますが、Ⅱ型、Ⅲ型の中枢神経症状には効果がありません。ただし、経口投与なので、患者さんのADL、QOLは改善されます。
また、エリグルスタットはCYP2D6 という薬物代謝酵素によって高度に、また、CYP3A によって一部が代謝されるので、この薬を使う前に患者さんのCYP2D6 の表現型を必ず調べる必要があります。
また、エリグルスタットはCYP2D6 という薬物代謝酵素によって高度に、また、CYP3A によって一部が代謝されるので、この薬を使う前に患者さんのCYP2D6 の表現型を必ず調べる必要があります。
- CYP2D6の表現型による用法・用量
CYP2D6 の表現型には、判定不能は別にして4 種類の表現型があります。Extensive Metabolizer(EM)、Intermediate Metabolizer(IM)、Poor Metabolizer(PM)、Ultra Rapid Metabolizer(URM)です。EM、IMでは100mg、1 日2 回投与ですが、PMでは1 日1 回投与です。URMについては、投与はできません。以上のように、まずCYP2D6 の表現型をチェックして、そして、投与量と使用できるか否かをチェックします。
また、CYP2D6 阻害薬やCYP3A阻害薬を併用している場合、併用注意や慎重投与する必要があります。CYP2D6阻害薬との併用投与では、EMとIMでは1 日1 回の投与で対応できます。CYP3A 阻害薬との併用投与では、IMとPMは禁忌になります。ですから、CYP2D6 の表現型だけでなく、併用薬にも注意しなければいけないのが、この薬の大きな問題です。成人のゴーシェ病の患者さんの中には高血圧などを合併している方も多く、併用薬に注意しないとなかなか使いにくい場合があります。
また、CYP2D6 阻害薬やCYP3A阻害薬を併用している場合、併用注意や慎重投与する必要があります。CYP2D6阻害薬との併用投与では、EMとIMでは1 日1 回の投与で対応できます。CYP3A 阻害薬との併用投与では、IMとPMは禁忌になります。ですから、CYP2D6 の表現型だけでなく、併用薬にも注意しなければいけないのが、この薬の大きな問題です。成人のゴーシェ病の患者さんの中には高血圧などを合併している方も多く、併用薬に注意しないとなかなか使いにくい場合があります。
未治療のゴーシェ病Ⅰ型の患者さんに対するサデルガ®の効果
未治療のゴーシェ病Ⅰ型の患者さんに対するサデルガ®群の短期効果(投与期間39週間)をプラセボ群と比較した、第Ⅲ相、無作為二重盲検試験の結果では、肝・脾容積の変化率、ヘモグロビン値変化、血小板数の変化において、サデルガ®群は有意に優れる改善効果を示しています。
未治療のゴーシェ病Ⅰ型の患者さんに対するサデルガ®群の長期効果(投与期間4年間)をベースラインと比較した、第Ⅱ相、非盲検多施設共同研究の結果では肝・脾容積、ヘモグロビン値、血小板数の4 つのパラメータにおいて有意な改善が認められました。
ただ、残念ながら、サデルガ®は中枢神経症状に効果がありません。現在、中枢神経症状に効果がある経口の基質合成抑制薬、ベングルスタットのゴーシェ病Ⅲ型に対する国際共同臨床第Ⅱ相試験が始まりました。
未治療のゴーシェ病Ⅰ型の患者さんに対するサデルガ®群の長期効果(投与期間4年間)をベースラインと比較した、第Ⅱ相、非盲検多施設共同研究の結果では肝・脾容積、ヘモグロビン値、血小板数の4 つのパラメータにおいて有意な改善が認められました。
ただ、残念ながら、サデルガ®は中枢神経症状に効果がありません。現在、中枢神経症状に効果がある経口の基質合成抑制薬、ベングルスタットのゴーシェ病Ⅲ型に対する国際共同臨床第Ⅱ相試験が始まりました。
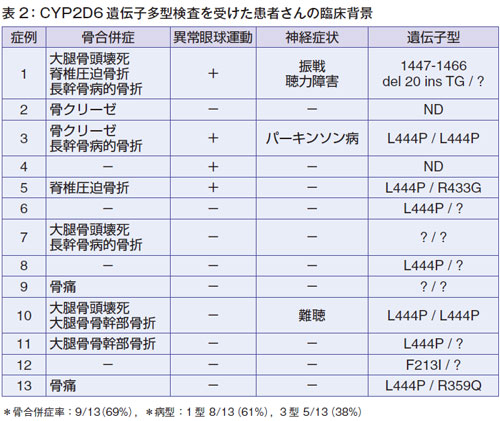
CYP2D6 遺伝子多型検査を受けた患者さんの臨床背景
表2に慈恵医大にCYP2D検査を受けにきた患者さんのバックグラウンドを示します。
原則的にⅠ型の患者さんを想定していましたが、中には異常眼球運動、神経症状がある神経型の患者さんも混在していました。4割の方はⅢ型でした(表2の症例1,3,4,5,10)。骨合併症は約7割の方に認められました。
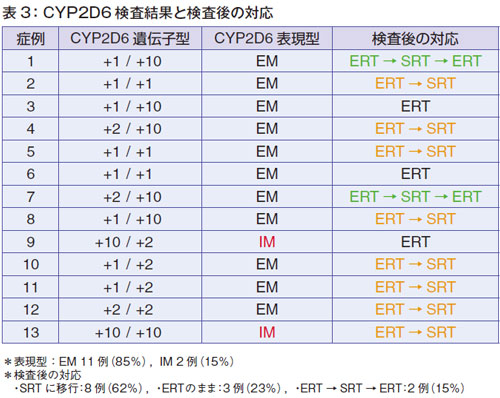
CYP2D6 遺伝子多型は、13例のうち11例がEMで、IMが2例でした(表3)。従って、全例にサデルガ®が使用できることになります。
原則的にⅠ型の患者さんを想定していましたが、中には異常眼球運動、神経症状がある神経型の患者さんも混在していました。4割の方はⅢ型でした(表2の症例1,3,4,5,10)。骨合併症は約7割の方に認められました。
CYP2D6 遺伝子多型は、13例のうち11例がEMで、IMが2例でした(表3)。従って、全例にサデルガ®が使用できることになります。
13人の患者さんが、基質合成阻害療法(SRT)を希望して検査に来ましたが、全例、基質合成抑制療法に移行したかというとそうではなく、移行例は8 例だけでした(表3)。検査を受けても、3 例の方は酵素補充療法をそのまま続けています(表3 の症例3,6,9)。理由は、1 例は妊娠の可能性があるとのことでした。基質合成抑制療法は妊婦さんには禁忌です。乳汁移行するので授乳はできません。あとの2例は、酵素補充療法のままでよいとのことでした。また、2例の患者さんが、1回SRTにしたのですけれども、副作用の関係でERTに戻しています(表3の症例1,7)。
基質合成抑制療法(SRT)への移行を考えた理由
「なぜ基質合成抑制療法を考えたのか?」を医師にアンケートした結果、一番回答数が多かったのが「患者さんの負担軽減(QOLの向上、来院期間の延長)」でした。
次に多かったのが「治療コンプライアンスの向上(酵素補充療法のスキップの防止)」、「SRTの効果への期待」です。
「SRTの効果への期待」は、「SRTは骨症状に有効である」という報告が出ているので、骨合併症への期待です。
その他、「血管確保が困難」、「ERTのバックアップ(ERTに供給制限があったときにSRTにスイッチすることを想定し、CYP2D6 の表現型を調べて使用できることを確認しておきたい)」という回答がありました。
次に多かったのが「治療コンプライアンスの向上(酵素補充療法のスキップの防止)」、「SRTの効果への期待」です。
「SRTの効果への期待」は、「SRTは骨症状に有効である」という報告が出ているので、骨合併症への期待です。
その他、「血管確保が困難」、「ERTのバックアップ(ERTに供給制限があったときにSRTにスイッチすることを想定し、CYP2D6 の表現型を調べて使用できることを確認しておきたい)」という回答がありました。
日本人のゴーシェ病の実態とその課題
次に、ゴーシェ病の移行期医療について、話を移したいと思います。
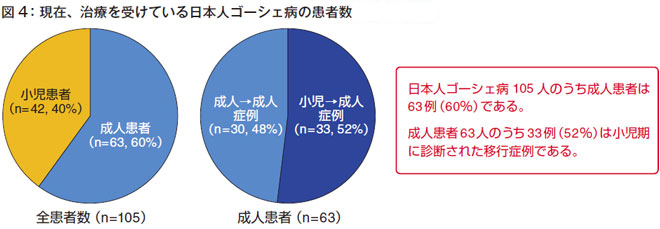
現在、治療を受けているゴーシェ病の患者さんは、日本全国で105名です。そのうち63名(60%)が成人患者さんです。日本人ゴーシェ病の発症時期は約8 割が小児期ですが、1996年、酵素補充療法が認可されてから22年経過していますので、認可されて間もなく酵素補充療法を開始した小児患者さんは成人になっています。
成人患者63人のうち、成人で診断された方が30人、小児期に診断された方が33例です(図4)。
成人患者63人のうち、小児科医が診ている例が約54%です。あとは血液内科、クリニック、整形外科、神経内科、消化器内科の医師が診ています。
現在、治療を受けているゴーシェ病の患者さんは、日本全国で105名です。そのうち63名(60%)が成人患者さんです。日本人ゴーシェ病の発症時期は約8 割が小児期ですが、1996年、酵素補充療法が認可されてから22年経過していますので、認可されて間もなく酵素補充療法を開始した小児患者さんは成人になっています。
成人患者63人のうち、成人で診断された方が30人、小児期に診断された方が33例です(図4)。
成人患者63人のうち、小児科医が診ている例が約54%です。あとは血液内科、クリニック、整形外科、神経内科、消化器内科の医師が診ています。
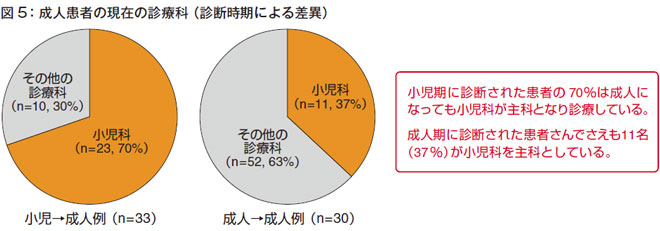
成人患者の現在の診療科を診断時期による差異で分けてみてみると、小児期に診断された患者さんの約7割は、その後もずっと小児科が診ています。
成人で診断された方は、その他の診療科で診ている場合が多く、小児科が診ているケースは11例と少ないです。それでも11例(37%)は小児科医が診ているというのが現状です(図5)。
成人で診断された方は、その他の診療科で診ている場合が多く、小児科が診ているケースは11例と少ないです。それでも11例(37%)は小児科医が診ているというのが現状です(図5)。
それでは、小児科医がずっと成人のゴーシェ病患者さんを診ていてよいのでしょうか。成人のゴーシェ病に認められる合併疾患がいろいろあります。例えば、パーキンソン病は成人ゴーシェ病においてはオッズ比が21.4 とかなり高頻度です。成人ゴーシェ病において、多発性骨髄腫(Multiple Myeloma)のリスク比も高くなることが知られています。
リンパ腫、白血病などを含む血液系のがんも非常に多いです。またゴーシェ病患者では胆石の合併率が高いです。小児科医になじみの少ない疾患が成人型ゴーシェ病で認められるので、成人のゴーシェ病の診療をどのように行っていくか、移行期医療の問題も含めて今後の大きな問題だと考えています。
リンパ腫、白血病などを含む血液系のがんも非常に多いです。またゴーシェ病患者では胆石の合併率が高いです。小児科医になじみの少ない疾患が成人型ゴーシェ病で認められるので、成人のゴーシェ病の診療をどのように行っていくか、移行期医療の問題も含めて今後の大きな問題だと考えています。
まとめ
以上を要約します。
- 日本人ゴーシェ病は、ユニークな遺伝子変異分布・臨床表現型を呈し、神経型の頻度が高く、Ⅰ型においては重症型が多いという特徴があります。
- 化学シャペロン療法は中枢神経症状に効果があり、かつ経口薬であるという利点があるけれども、特別な遺伝子変異を有する患者さんにしか効果がないことが問題です。
- 基質合成抑制療法は経口薬という利点があります。貧血、血小板減少、肝脾腫には効果的ですが、CYP2D6の表現型と併用薬に注意しなければなりません。また中枢神経症状に効果がないというのが問題です。
- ゴーシェ病105 例のうち、63例(6 割)が成人患者であり、その63例中33例が小児からの移行症例です。そして移行症例の70%が小児科を主科としています。成人のゴーシェ病では種々な疾患の合併頻度が高く、移行期医療を含めて成人ゴーシェ病の診療体制をどのように構築していくかが今後の課題です。